昨日の学習時間:3h
「岡野の化学」ビデオ91
電気陰性度について学びました。
イオン化エネルギー、電子親和力と並んで3点セットで言われることが多いらしいですが(知りませんでした)、なぜ3点セットで捉えられることが多いのか。どこが同じ部分でどこが違うのか、というのを考えながら文章を読まなくてはいけない、という話は印象的でした。
明細書に取り組む者として、常に日本語の使われ方にアンテナを立てて敏感になっていなくてはならないですね。自分がどれだけその文章を理解しているか、本当に理解しているのか。
プロの目の付け所が違う点を認識させられました。
今日は、なぜ電気陰性度が大きい塩素では水素結合が起きないのかをまとめてみたいと思います。
電気陰性度とは
まず定義から。
電気陰性度とは、異なる種類の原子どうしが結合するとき、それぞれの原子が相手の電子を引き寄せる力を相対的に表した値です。
- 電気陰性度が大きいと、相手の電子を自分の方に強く引き寄せるため、局所的にマイナスの電荷を帯びます。(δ-)
- 電気陰性度が小さいと、自分の電子が相手の方に引き寄せられてしまうため、局所的にプラスの電荷を帯びます。(δ+)
一般的な傾向として周期表の右上側(希ガスを除いた非金属の典型元素)で値が大きく、周期表の左下側(アルカリ金属やアルカリ土類金属など)で値が小さくなります。
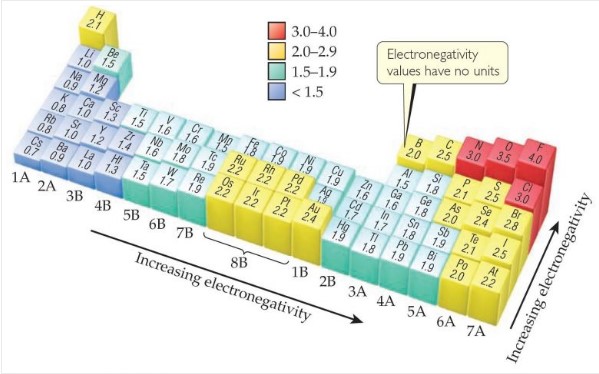
ちなみに遷移金属ではこの値にバラつきがあります。
これもやはりd軌道や遮蔽効果が関係していると思われます。
原子核の引力が外側の電子に及ぼす影響(有効核電荷)が物質によって様々なため、単純な周期的傾向が出ないのです。
調べると、実は電気陰性度の値を出すのには複数の尺度(ポーリング尺度、マリケン尺度、オールレッド-ローチ尺度など)を用いて定義しており、これらの尺度が結合エネルギー、イオン化エネルギ、電子親和力など異なる物理量をもとに算出されるため、特に結合の性質が複雑な金属元素においては数値にばらつきが生じやすいのです。
塩素(Cl)が水素結合しない理由
特に電気陰性度の高い元素としてF、Cl、O、Nが知られています。
これらの元素と結合した分子では、電子がこれらの元素側に偏るため、水素原子に部分的正電荷(δ⁺)が生じ、隣の分子の部分的負電荷(δ⁻)と相互作用して水素結合を形成します。
(例:HF、H₂O、NH₃)
ですがClだけは水素結合しません。なぜでしょうか。
まず電子配置を見てみます。ここではわかりやすくspdf軌道ではなくK、L、M殻という言葉を使用します。
比較のためにFとClを比べてみると、
- F : K(2)、L(7)
- Cl : K(2)、L(8)、M(7)
共に最外殻電子数は7です。
典型元素なので水素結合などの化学反応に関わってくるのはこの部分だけですね。
一見、Clの方が陽子の数(=電子の数)も多いため、ClはFより電気陰性度が大きくなりそうなものです。
でも実際は、先ほどの電気陰性度の大小を示した周期表を見た通り、陽子数の多さが電気陰性度の大きさには直接つながっていないのですね。(周期表の右上が一番大きいため)
じゃあ何が関係しているのかというと、原子の半径と電子密度が影響していると考えられています。
原子半径といってもいろいろありますがここでは深みに入らず、ファンデルワールス半径というのを使います。
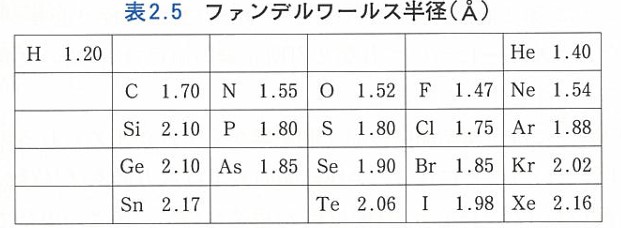
これを見ると、Clは FやO、Nに比べて半径が大きいことがわかります。
電子配置でもM殻まで電子が埋まっていてたのでわかりますよね。
原子半径が大きいと、それだけ電子が空間に広がって分布している、ということになります。局所的にみると電子の密度が低い、と言えます。
水素結合は、部分的にプラスの水素(δ⁺)と部分的にマイナスの電荷(δ⁻)を持つ原子との間の静電的相互作用によって成立します。
しかし、Clは原子半径が大きいため局所的な電子密度が低く、十分なδ⁻が形成されず、水素結合が起こりにくいのです。
世の中単純にはできてないんですね。複雑だからこそ面白い。








コメント