昨日の学習時間:5.5h
「岡野の化学」ビデオ95,96
共有結合、金属結合、配位結合と化学結合について学び、配位結合から混成軌道の復習をしました。
アンモニア分子がsp³混成軌道をとる理由
通常の理論(原子価結合法)でいくと…
アンモニア分子(NH₃)は窒素原子(N)と水素原子(H)3つが結合してできています。
各電子配置は以下の通り。
- N : 1s(2)、2s(2)、2px(1)2py(1)2pz(1)
- H : 1s(1)
これそのまま共有結合すると、H-N間の角度は90°になります。
なぜ結合角度が90°になるかというと、
各p軌道はそれぞれ一方向(例えばx軸、y軸、z軸)に向かう大きなローブを持ち、互いに直交(90°の角度)した方向に配置されるからです。
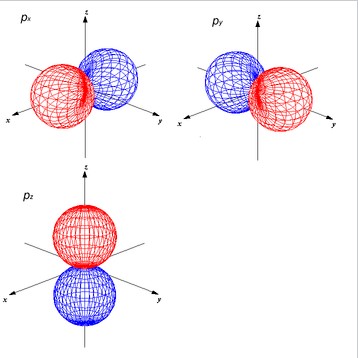
そのため、通常の理論でいくと、N–H結合は90°の角度をとることになります。
しかし、実際のアンモニア分子では、正四面体の配置をとります。(理想的には109.5°、でも実際は107.6°)
この理論と実際の観測地との溝を埋めるために使われるのが混成軌道という考えです。
どういうふうに考えるかというと、
先ほどの電子配置をみると、窒素原子には2s軌道と2p軌道というエネルギーが異なる軌道が存在します。
しかし、アンモニア分子では窒素が3つの水素原子と結合するため、できるだけ均一な結合を作りたいと考えます。そのために、窒素はこれらの軌道(2s(2)、2px(1)2py(1)2pz(1))を混ぜ合わせ、4つの同じ性質を持つ「sp³軌道」を作ります。
この混成の過程で、理論上、2s軌道の電子が「昇位」する、つまり本来低いエネルギーにあるs軌道の電子が、より高いエネルギー状態であるp軌道に近づくように再配分されると考えられます。
エネルギーのバランスと混成軌道の形成
ここで気になるのは、「昇位」するためにエネルギーが必要ではないか?という点です。
実は、混成軌道を作るときは、単に電子をs軌道からp軌道に移動させるのではなく、s軌道とp軌道を線形結合(足し合わせること)します。
この辺りは私もまだよくわかっていないので、表面的な理解になりますが、簡単にまとめると以下の通りです。
線形結合と寄与の調整
それぞれの軌道は、波動関数という数学的な表現で記述されます。
混成軌道は、各元の軌道の「寄与(振幅)」を調整して作られます。理想的なsp³混成では、各軌道に1/2の係数を与えます。
この係数を二乗すると (1/2)² = 1/4 となり、4つの軌道がそれぞれ1/4ずつ電子密度に寄与して、合計で1になる(全電子密度が保存される)仕組みになっています。
エネルギー的な相殺
もともとs軌道とp軌道はエネルギーが異なりますが、混成軌道のエネルギーはその中間の値となります。
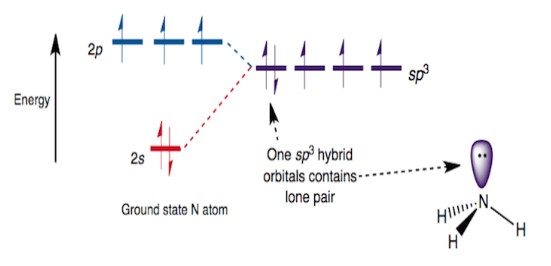
そして、混成軌道を用いることで、各N–H結合がよりよく重なり合い(オーバーラップが良くなる)結合エネルギーが増します。
この「結合エネルギーの増加」が、昇位によるエネルギーのコストを十分に補償し、結果として分子全体が安定化するのです。
結合角が正四面体より小さい理由
混成軌道の概念をもってすれば、アンモニア分子はメタン分子と同じように正四面体構造をとり、結合角が109.5°になるはずですが、実際はそれよりも小さい107.6°となっています。
この原因は、窒素原子が非共有電子対(孤立電子対:ローンペア)を持っているために起こります。
窒素原子は5つの価電子を持ち、そのうちの3つを水素と共有結合し、残りの2つは結合相手がいない状態で存在しています。この孤立電子対は、共有結合電子対とは異なり、2つの原子核に挟まれることなく窒素原子1つの原子核からしかクーロン引力を受けないため、電子分布範囲が広く、電子雲が膨らんだような状態にあります。
そのため、隣の水素との共有電子対と強い静電反発を生じ、結果H-N-N間の角度が理想的な正四面体角(109.5°)よりも狭められたと考えられています。
混成軌道の形
以前有機化学で学んだときは、画像をノートに切り貼りして理解したつもりになっていたのですが、今回軌道の形も手書きすることで、混成軌道の形が頭に刻まれました。
以前、「なぜ混成軌道の形は片方だけが膨らんでいるんだろう…」と思ったまま忘れていましたが、今回手書きする際に調べなおしました。
すると先ほど記述した波動関数の寄与度(振幅)とか、電子密度は波動関数の二乗に比例する…などの話になり、だんだんと話が難しくなってきました。
参考になる大学(理工学部)の講義資料を見つけたので、疑問に思ったら何度もこの資料を参考にしようと思います。
ひとまず、1/4個のpx軌道+ 1/4個のpy軌道+ 1/4個のpz軌道を足して、そこに1/4個の2s軌道を足すと、あのヘチマのような混成軌道の形になる、ということがわかりました。
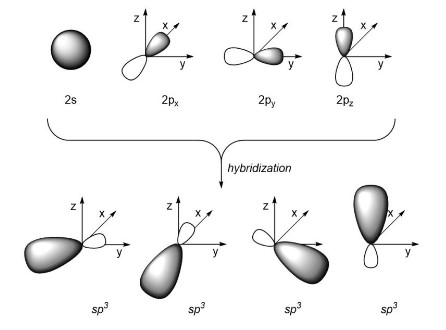
翻訳者がここまで知っておく必要があるかわかりませんが、とりあえずそういうものだと思って先に進みます。









コメント