昨日の学習時間:5h
「岡野の化学」ビデオ86,87
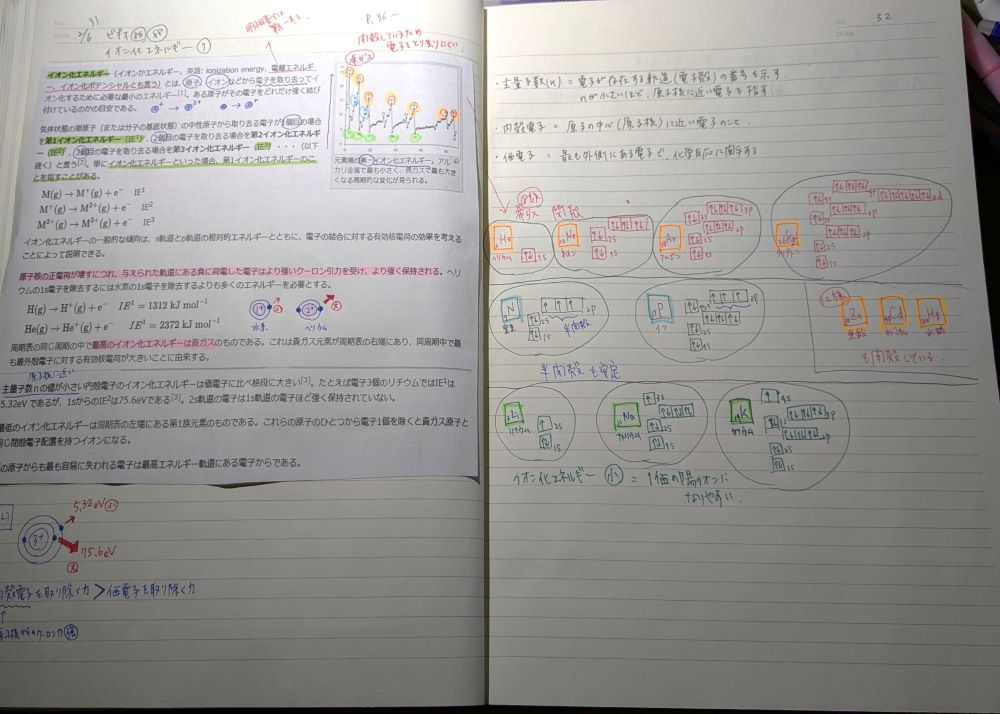
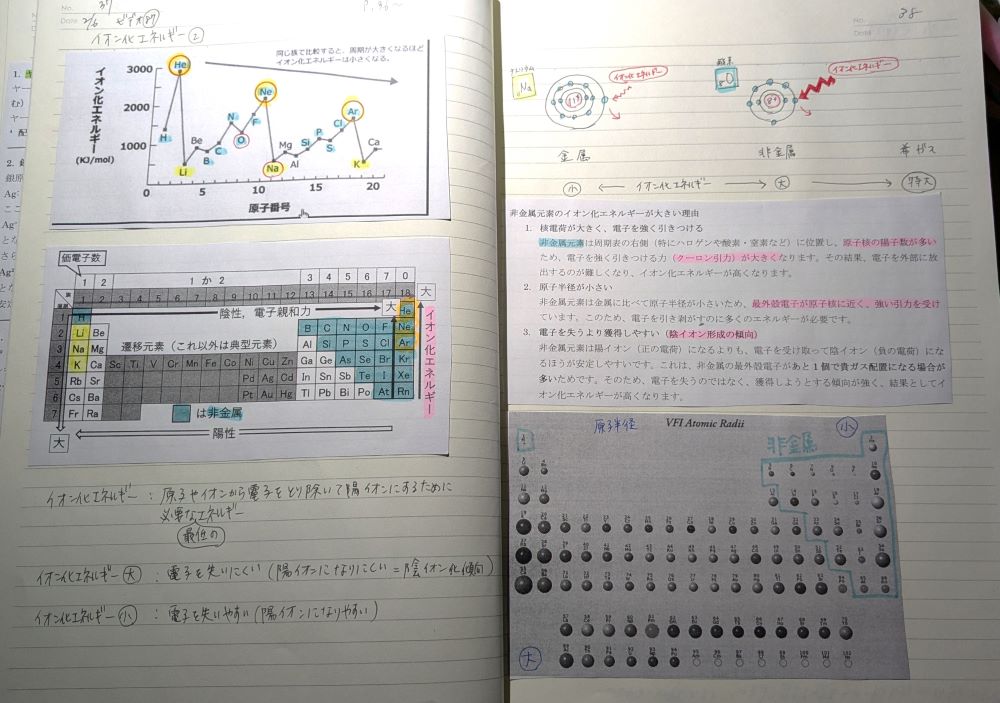
価電子、イオン、イオン化エネルギーについて学びました。
価電子とは化学結合に関わる電子のことで、18族を除く典型元素においては最外殻電子=価電子を指します。
18族は各軌道が定員まで電子が埋まって閉殻しており安定しているため、価電子は0。
じゃあ遷移元素の価電子は何個かというと、「一般的に1 or 2」ですが、単純には言い切れないのです。
なぜか。
遷移元素では、化学結合に使われる電子が最外殻電子だけでなく、内側の電子も使われるので、化学結合の場合によっては数が変動するためです。
原子番号21~30番までの1列は最外殻のN殻(4s軌道)に電子が2つ入り、内側の3d軌道に順次電子が埋まっていく構造です。なので基本、反応に使われる価電子数は2と言えます。
ですが例外もあって、前回取り上げた銅の場合は最外殻であるN殻の4s軌道に通常は電子は1つしか入っていません。
遷移元素において4s軌道と3d軌道はエネルギー的にも非常に近く、また安定化するためにも4s軌道の電子は3d軌道に入ります。(詳しくは昨日の記事↓)
そうなると価電子数は4s軌道に残る電子1です。
(※ただし銅イオンはCu+よりもCu²+の方がなりやすい。この場合は価電子数は2)
ですが原子番号25番のマンガン(Mn)の価電子数は7です。
マンガンの電子配置は、1s22s22p63s23p64s23d⁵ で、4sと3dの電子7個のうち2個、3個、4個、6個、7個を価電子として失う場合があります。マンガンはMn2+、Mn3+、Mn4+、Mn6+、Mn7+のイオン式を持つ のです。
このように遷移元素の価電子数は典型元素ほど規則的ではありません。
調べれば調べるほど遷移元素の複雑性が出てきて深みに入りそうです…無機化学が楽しみになりました!









コメント