2/7の学習時間:5h
「岡野の化学」ビデオ88、89
2/8の学習時間:1.5h
「岡野の化学」ビデオ90
電子親和力について学びました。
これまで「自分で仮説を立ててから勉強を進める」ということをあまりしてこなかったので、やってみました。
イオン化エネルギーと周期表の関係については既に学んでいたので、そこから得た知識をもとに、電子親和力と周期表の関係を、自分で「なぜこうなるのか」を考えてからビデオを視聴して、答え合わせをしてみました。
電子親和力というのが実際に計算結果で出ているので、そういうもの、と暗記してしまえば楽ですが、きっとすぐ忘れるでしょう。なので自分が納得するまでとことん考えました。
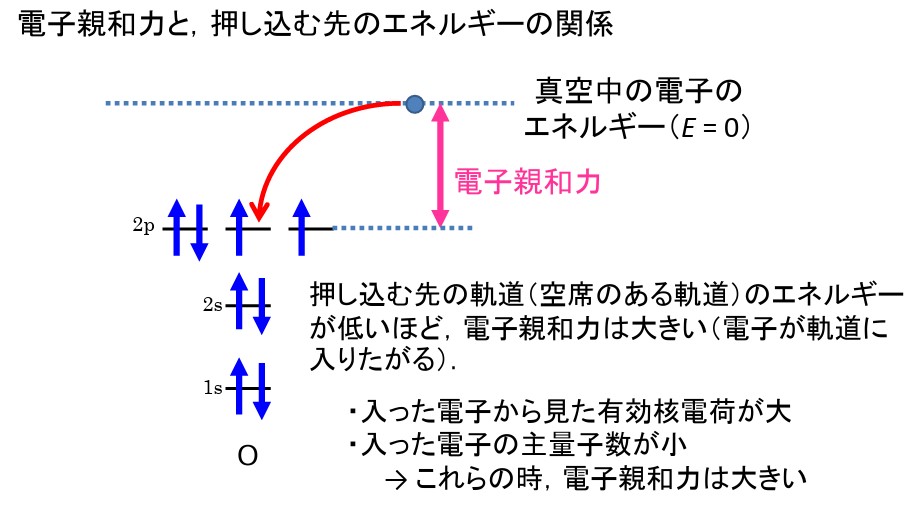
電子親和力とは、気体状態の原子が電子を1つ取り込んだ時に放出、または吸収されるエネルギーのことです。
最初、電子親和力を名前から連想して「電子を取り込みやすい性質」と単純に解釈したため、納得いかない点がちらほら出てきて苦しみました。
電子親和力はざっくり言って、非金属元素(特にFやClなどのハロゲン)では数値が高く、金属元素では数値が低く出ています。18族の希ガスはさらに低い数値になっています。この理由を考えました。
① ハロゲンで数値が高くなるのは、電子配置があと1つ電子を受け取れば閉殻となり安定するため、電子を引き付け る力が大きいため
② 非金属元素は、陽子数が金属元素に比べて多いので、原子核からのクーロン力(引力)も強く働く。よって電子を引き付ける力も大きい。
でもこう考えると、電子親和力=電子を引き付けやすさ、となって、定義にある、電子を取り込んだ時のエネルギーとの関連が曖昧です。
非金属元素では電子を取り込みやすい=取り込んだ時のエネルギーが大きい(電子親和力が大きい)、とはならないんじゃないの…?結びつきがよくわかりません。
取り込んだ時のエネルギーが大きいとは、取り込んだ時のエネルギーの放出が大きいということです。
①の理由はひとまず置いておいて、
②の原子核からのクーロン力(引力)が強いと、なぜエネルギーの放出が大きいのか?
調べると、物理の分野でした…
簡単にまとめると、
電子は負の電荷を持ち、原子核は正の電荷を持つため、両者の間にはクーロン引力(静電気的な引力)が働きます。
ハロゲンのように原子核の正電荷が大きい(陽子数が多い)場合、この引力は強くなります。
その結果、自由な状態にあった電子が原子に取り込まれるとき、電子は原子核に強く引き寄せられ、エネルギー的に低い状態に移行します。このとき、エネルギーの差分が放出されるエネルギーとなります。
非金属元素は金属元素に比べて陽子数が大きいため、原子半径は小さく、内側の電子による遮蔽効果を除いても原子核からの正電荷の引力は大きいです(これを有効核電荷数といいます)。
なので電子が軌道に入り込んだ際、よりエネルギーが低い状態になります。
したがって、原子核からの引力が強いほど原子の軌道は引力を強く受けてエネルギーが低いので、そこに入る電子のポテンシャルエネルギーも大幅に下がることになり、その差分として放出されるエネルギーも大きくなる。
具体的には以下の計算式があるらしいので、それで簡単に出せるみたいです。
U = – (k · Z · e²) / r
Zは原子核の正電荷(陽子数や有効核電荷)、rは電子と原子核間の距離、kは比例定数。
非金属元素はrが小さく、Zが大きい状態となるので、ポテンシャルエネルギーUはより大きな負の値、つまりエネルギー的に低い状態になります。
この現象が、電子親和力の大きさとして表されるのです。
物理は避けて通れない道、とはっきり認識。
次に進みます。









コメント