飽和蒸気圧について学習しました。
飽和蒸気圧と湿度
「飽和蒸気圧」とは、ある温度において、空気が含むことのできる目いっぱいの水蒸気の量を圧力で示したものです。
例えば雨が降ってジメジメとした天気の日、「湿度が高い」って言ったりしますが、これは、その温度における空気が、含むことのできる水蒸気量の限界値近くまで水蒸気をふくんでいる状態を指します。
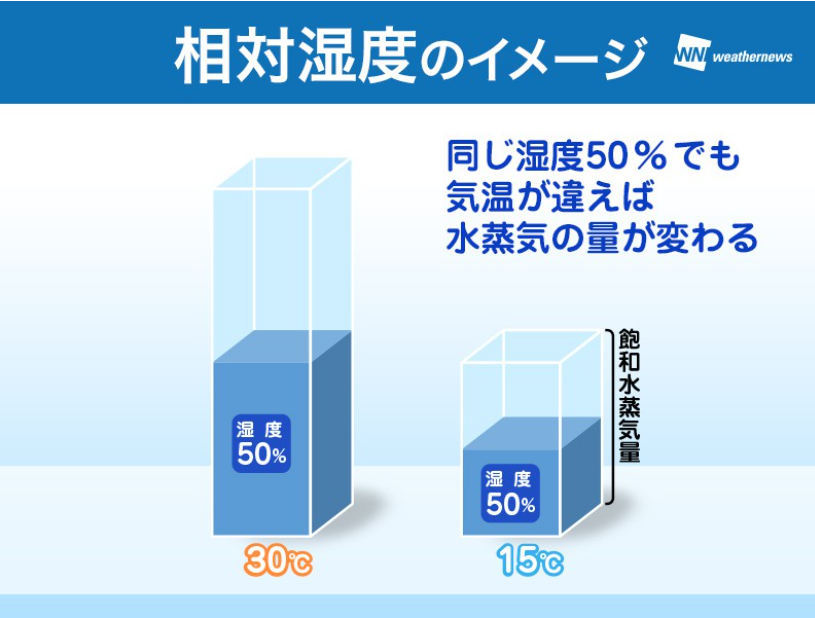
気象の世界ではこれを「相対湿度」という言葉で表し、以下の式で求めます。
相対湿度 (%) = (求めたい空気中の水蒸気分圧 ÷ 空気温度における飽和水蒸気圧) × 100
ある温度における飽和水蒸気量(圧)のうち、現在水蒸気は何%占めているのか、という水蒸気の割合がこれでわかります。
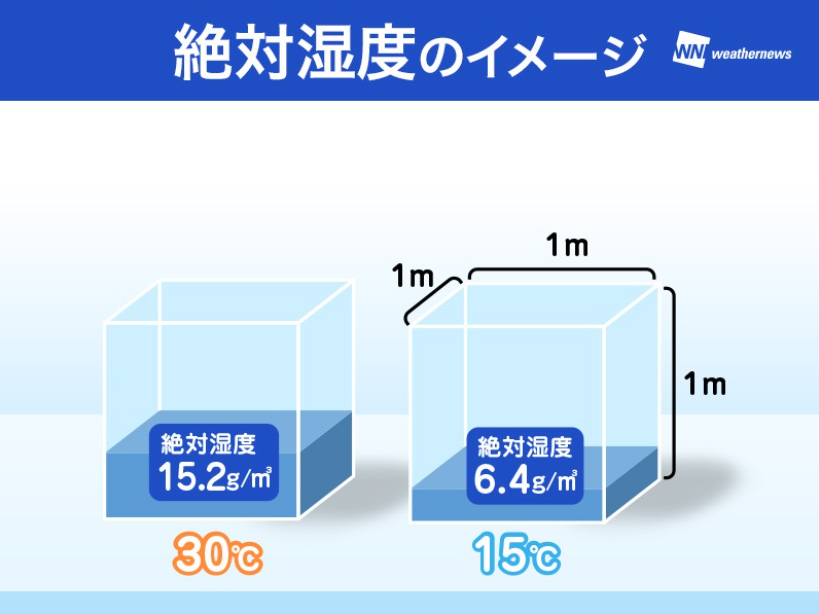
水蒸気量を表すのにもう一つ、「絶対湿度」という言葉があります。
こちらは温度に関わらず、1㎥中に水蒸気が何gあるか、という「水蒸気自体の重さ」を表します。
微細加工の世界では、わずかな水分量でもプロセスに影響が生じるため、絶対湿度での管理が必須になります。
空調(HVAC)、半導体製造、医療・製薬、食品加工、自動車 の分野など、結露が出ると困る業界では「絶対湿度センサ」など、絶対湿度を測定する特許が数多く出されています。
「蒸気圧」と「水」に関する特許
普段、特許を検索していても、技術知識が不十分なため、いつも内容をしっかり読むことができていません。
ですが、今回は初心者にもイメージしやすい、身近なものを扱った特許がありましたので、【背景技術】と【課題を解決するための手段】について深堀してみることにしました。
内容は「水の蒸気圧低下剤」についてです。
何に使われているかというと、洗面台や流しの排水管に設けられている排水トラップです。
排水トラップとは、排水管の下水側から悪臭が室内に入ったり、害虫等の生物が室内に入るのを防止するために、排水管の中に溜めている水(封水)の部分を指します。
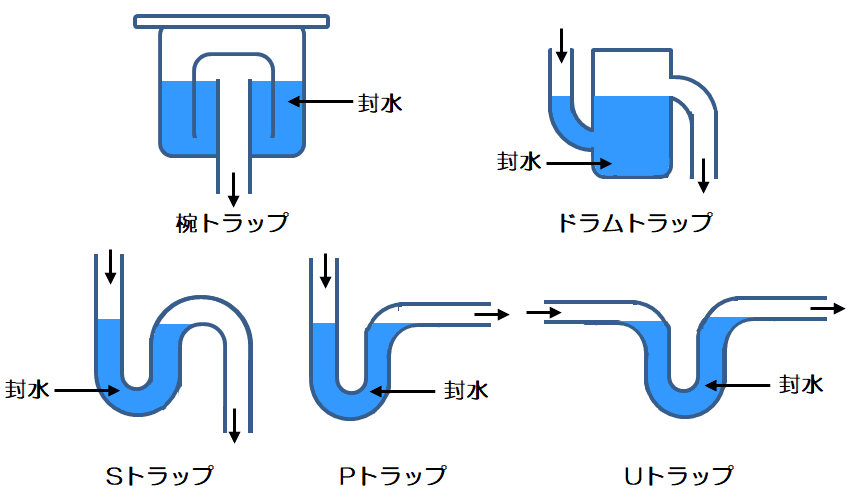
この封水が、家を不在にしたり、マンションの借り手がいない等の理由によって、長期間洗面台、流し台等を使用しない場合に、蒸発して(渇水して)下水側から悪臭が室内に入ったり、害虫等の生物が室内に入るという問題があります。また、寒冷地では封水が凍ってしまう、という問題もありました。
従来は、封水の蒸発を防ぐために、封水に油を投入して水面を被覆したり、寒冷地では凝固点の低いエチレングリコールが使われいましたが、油は投入した際に、封水の中を排水口側から下水側へ移動しづらいという課題があり、また、エチレングリコールは致死量が設定されている毒劇物であって、自然界に流出すると危険性が高いという課題がありました。
そこで、この特許では安全で、封水と混合しやすく寒冷地でも使用可能な水の蒸気圧低下剤について取り上げています。
構成成分は、
- 尿素
- 界面活性剤
- 精製グリセロール
- 水又はアルカリ還元水
となっています。
では、これらの成分がなぜ蒸気圧を下げ、上記課題の解決につながるのか、を調べてみました。
結果、化学の復習になり、また新たに「毛細管現象」について学べました。
1,尿素の役割
尿素を入れた理由はこう書いてあります。
- 水に溶けやすい
- 水の凍結温度を下げる(寒冷地でも凍らなくする)
- 水の沸点を上げる(蒸発しにくくする)
水に溶けやすい
まず尿素が水に溶けやすいのは、尿素(CO(NH2)2)が極性分子だからです。
分子の構造として「ーNH2」というアミノ基をもち、これが水分子と水素結合をするため水によく溶けます。
水素結合とは、電気陰性度(電子を引きつける力)の大きい原子(フッ素、酸素、窒素など)と結合した水素原子が、別の分子の電気陰性度の大きい原子の持つ電子対と引き合い、形成される弱い結合のことをいいます。
尿素の場合、アミノ基の水素原子(δ+)と、水分子(H2O)の酸素原子(δ-)が引き合い、それぞれの共有結合よりは弱い力で引き付けあっています。
凍結温度を下げる
凍結温度が下がる理由は、尿素が不純物となり、氷の規則正しい結晶構造を作る邪魔をすることで、氷が結晶構造をとるよりも低い温度が必要になるからです。
これは「氷点降下」「凝固点降下」とも言われる現象で、凍結予防として、冬に道路に食塩をまくのと同じ理由です。
不純物があることで、通常水が冷やされて凍る凝固点よりもさらに低い温度でなければ凍らなくなります。
尿素の凝固点は、純粋な状態では132.7~135℃ですが、尿素を水に溶かして尿素水溶液にすると、凝固点は低下し、例えば、32.5重量%の尿素水溶液の凝固点は-11℃です。
沸点を上げる
水の沸点を上げる理由は、先ほどの水分子との水素結合があげられます。
水が沸点で沸騰するというのは、水分子が外部より十分なエネルギー(熱エネルギー)を得ることによって、運動エネルギーが増大し、空気中へ飛び出す現象のことです。
ところが水分子と尿素が水素結合をしていると、いわば水分子が尿素に「つかまっている」ような状態となり、それだけ余分にエネルギーが必要になるため、もっと高い温度(エネルギー)にしないと簡単に蒸発できない、ということになります。
この現象を「沸点上昇」「蒸気圧降下」といいます。
蒸気圧とは、液体や固体が気体になったとき、その気体がもつ圧力のことを指します。
※ここでややこしいのは、気体と液体とが平衡状態にあるときの圧力のことを特に「飽和蒸気圧」というのですが、これを単に「蒸気圧」とも言うようです…。特に高校レベルの学習サイトなどには、気液平衡の時の圧力を「蒸気圧」といっていたりして、初学者の私は混乱したりしました。
まとめると、
| 蒸気圧 (vapor pressure) | 液相と平衡しているかに関係なく、蒸気が与える部分圧 | 一般的な用語、気象学では実際の水蒸気分圧 |
| 飽和蒸気圧 (saturated vapor pressure) | 気液平衡にあるとき、その温度で定まる蒸気圧 | その温度での限界値、平衡圧 |
平衡状態とは、液体状態の分子が運動エネルギーが増大し、分子間力を振り切って液面を飛び出して気体になる「蒸発」と、気体分子の運動エネルギー減少し、分子間力に引っ張られて再び液体に戻る「凝縮」という現象がちょうど同等に釣り合った状態(見かけ上)のことをいいます。
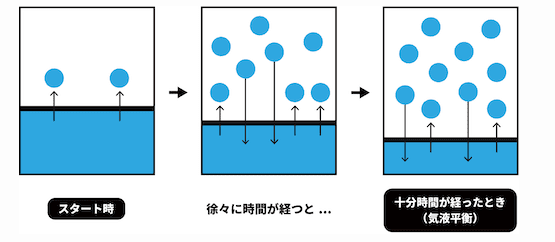
蒸気圧降下とは、溶質を入れると溶媒の蒸発力が下がる現象のことをいいます。
純粋な溶媒(例:水)は、ある温度で一定の「飽和蒸気圧」を持ちます。
そこに非揮発性の溶質(例:食塩や砂糖)を溶かすと、溶媒分子の表面に「溶質分子」が割り込んできます。
(非揮発性とは、液体から気体になりにくい性質のことです。)
すると、もとの溶媒分子は気体に逃げ出すチャンスが減るため、蒸発しにくくなります。結果として、蒸気圧が純溶媒より低くなる現象が起こるのです。
この蒸気圧降下には「ラウールの法則」という「蒸気圧は溶媒の割合に比例して下がる」という法則と数式があるのですが、これについてはまた別の機会にします。
2,界面活性剤の役割
封水に界面活性剤を入れる理由としては、
- 水の表面張力を下げる(蒸発しにくくなる)
- 毛細管現象を防ぐ
とありました。
表面張力とは
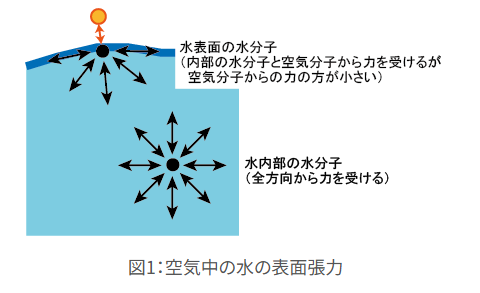
まず「水の表面張力とは何か」について学ぶ必要がありました。
液体の水分子がどういう状態かというと、分子同士が水素結合で引き合っている状態です。
水の内部では一つの水分子は全方向から水素結合により力を受けていますが、液体表面の水分子は上方向、つまり空気と触れている部分には水分子がないのでその分力を受けておらず、エネルギー的に不安定な状態になっています。
ここで化学の根本的な法則。
「物質は安定な状態(エネルギーが低い状態)を好む」
が働きます。
このままの状態ではエネルギー的に不安定なので、分子は安定な状態をとろうとします。
具体的には、不安定な状態の表面の面積を小さくしようとします。
水滴が球形をとるのも、球形という形は同じ体積の中でも最も表面積が小さい形だからです。丸くなることで、水は空気との接触面積を小さくしているのです。
他にもコップの水が縁で盛り上がったり、葉の上の水滴が丸くなったりする現象などがあげられます。
表面張力とは、液体や固体が、表面をできるだけ小さくしようとする性質のことをいいます。
表面張力を下げる
では、界面活性剤を水に混ぜるとなぜ表面張力が下がるのでしょうか?
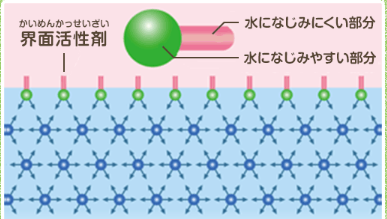
界面活性剤の構造は、「親水基」という水になじむ部分と「疎水基」という水を疎み、油になじみやすい部分とでえdきています。
この界面活性剤を水に入れると、界面活性剤分子が液体表面に移動し、「親水基」を水側に「疎水基」を空気側にして整列します。
すると水の表面は水分子同士の水素結合だけでなく、水分子と界面活性剤との相互作用も加わります。界面活性剤分子が水のネットワークを壊すため、表面張力が下がるのです。
表面張力が下がると、水は広がりやすく(濡れやすく)なり、また蒸発しにくくなります。
界面活性剤分子が液体表面を蓋のように覆うことで、水分子が直接空気に触れる割合が減り、結果、気体になりにくくなるのです。
毛細管現象とは
毛細管現象とは、細い管状物体(毛細管)の内側の液体が、外部からエネルギーを与えられることなく管の中を移動する物理現象のことです。(Wikipedia)
もう少しわかりやすく言うと、毛のように細い管や、それに似た細かな隙間を持つ物体に液体が浸み込んだり、その液面が重力に関係なく、上昇または下降したりする現象です。
これは、液体の表面張力と、液体と固体の間にはたらく付着力(濡れ性)の関係によって起こります。
付着力とは、液体の分子と固体の表面との間に働く引きつけ合う力のことをいいます。接触角 θで表され、cosθが大きい(=θが小さい)ほどよく濡れて上昇しやすいです。
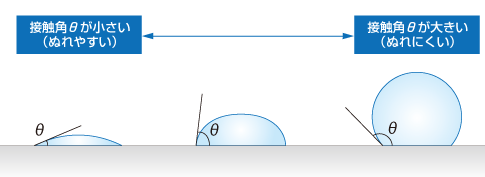
液体の表面張力より液体と固体の付着力が強いと、液体は管の壁に「くっつきたがる」ので、管の中で液体が上昇します。壁に近いところがよりくっつきやすく、盛り上がって見えます(メニスカスという)。
(例:水+ガラス)

ガラスの主成分は二酸化ケイ素 SiO₂です。
ガラスの表面には Si–OH(シラノール基) が存在しており、これが「極性」を持っており、同じく極性分子の水分子と水素結合を成すため(水の分子のO(δ⁻)とガラス表面の –OH のH(δ⁺)の間)、 水はガラス表面に「強くくっつく」(付着力が大きい)のです。
そのため、管の内側を「濡らしながら」上昇し、メニスカスは下にへこんだ形になります。
反対に付着力より液体の表面張力の方が大きいと、液体は自分同士でまとまりたがり、管の壁から離れます。
(例:水銀+ガラス)

水銀は金属元素が集まった金属結合でできています。
金属元素は極性をもたないので、極性を持つガラス分子と相互作用が起きにくいです。
そのため、ガラス表面を「濡らさず」、液面は盛り上がった凸形(上にふくらむメニスカス)になります。
毛細管現象の身近な例としては、植物が根から水を吸い上げる、タオルが濡れる、万年筆のインクが出る、といった現象があげられます。
排水トラップの場合、排水管内壁の細かいひび割れやゴミなどに水が引き上げられてしまい、蒸発しやすくなる、という問題に繋がっています。
表面張力が下がると毛細管現象が起きにくくなる
上記の「水+ガラス」のように、「表面張力が高い」+「付着力が強い(よく濡れる)」物質同士 ほど毛細管現象が強く起きます。
「水銀+ガラス」のように、「表面張力が高い」+「付着力が弱い(=接触角が大きい、濡れにくい)」物質同士だと逆に下降します(凹ではなく凸のメニスカス)。
これが「アルコール+ガラス」だとどうでしょう?
アルコールは水よりも表面張力が低いです。
表面張力(20℃前後)だと、
- 水:72.8 mN/m
- エタノール:約22 mN/m
- メタノール:約23 mN/m
アルコールは水の 1/3 程度の表面張力 しかありません。(参照:Wikipedia: Surface tension – Table of values)
ですが、水と同様、極性分子をもつためガラスと相互作用しやすく、「付着力は強い(濡れやすい)」です。
なので毛細管現象は起きるが水より高さは上がらない、という現象になります。
特許文献に戻ってみると、特に付着力については言及されておらず、界面活性剤の混入による表面張力の低下のみに利点が絞られています。
これは、付着力は「固体の材質(ガラス・金属・樹脂など)」によって左右されるため、 使用環境で変動が大きいことが理由と思われます。
一方、表面張力の低下は 液体側の性質として普遍的に作用するので、説明がしやすいのではないでしょうか。
この毛細管現象については、まだまだ深堀りできるのですが、今日はこの辺りにしておきます。
3,おわり
時間切れです…
この後「なぜアルカリ還元水を混ぜるのか?」について説明しようと思いましたが、さすがにブログ記事を書くのに時間かけすぎだと思い、またぞやの機会にします…
もっと早く記事を書けるようにならないといけませんね。私の中に化学のワードストックがないからでしょう。
今日はビデオ160を視聴し、先に進むことにします。








コメント