昨日はついてない1日でした…
まず昼間子供が全然寝ない、何やっても泣き止まない。加えてプリンターの調子がおかしい。
そして、冬休み頃から夜間の下の子の面倒を主人にお願いしてたのですが、夜中何回も起きる子なので睡眠不足が積み重なったのか、昨夜からバトンタッチ。
よって早朝の勉強時間の確保ができなくなりました。
主人も試験を控えていて勉強したいでしょうし、自分の都合ばかり押し付けることはできません。せっかく勉強と睡眠のいいリズムができていましたが、また睡眠不足にならない適度な勉強時間を模索していきます。
化学に対する苦手意識
昨日の学習時間は3.5h。理論化学に入りました。
原子モデル、原子構造が現在までにどのように考えられてきたのか、を知りましたが、これは学校の化学の勉強の最初に取り扱うべきだと思います!
なぜなら、もし私がこの部分の話を高校時代に聞いていたら、化学に苦手意識をもつことなく勉強ができたのではないかと思ったからです。
原子モデル、原子模型、原子構造…いろいろな言い方がありますが、ようはこれです↓
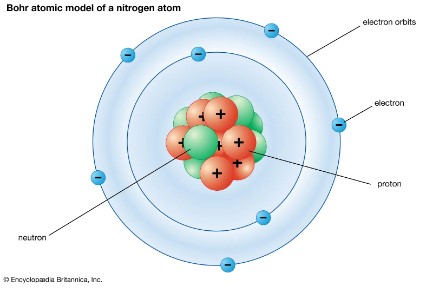
負電荷をもった電子が、原子核の周りにある軌道上を等速円運動しているというこの図。実際の電子は雲のように確率的に存在しているため正確にはこの図とは違う、ということは既に講座で学びました。
ですが私の記憶では、学校の授業ではいきなりこの図が提示され、「世の中のものは全て小さい粒である原子からできていて、その原子はこうなってるんだよ」と教わります。その背景が全然見えてこないないまま、授業は教科書に沿って型どおりどんどん進んでいきました。
ここで少しでも化学の世界に興味がある子供なら「なんでそうなったんだろう?」と思って自分で調べるのでしょうが、私のように全く興味がなかった子供は、「ふーん」で終わるか、「なんか胡散臭い、どうせ理論上の話で実際にそうなってるかわからないじゃん」とへそを曲げて、ますます化学の世界から遠ざかってしまうのではないでしょうか。
この一番最初の原子のところでうまく頭に内容が入ってこなかったがため、私は化学全拒否になってしまったように思います。
今私が化学の苦手意識を克服し、勉強を続けられているのは、講座を受講するにあたってまず「化学のドレミファ」を読んだのがキッカケです。そこでラザフォードのα線の実験を知って、原子構造について大まかに(つきつめていくと量子物理の世界になるので、そこは飛ばして)納得できたため、長年の何となくもっていた苦手意識を払拭し、今純粋に楽しみながら勉強できているのです。
化学の原子モデルの変遷の歴史は以下に簡単にまとめます。
一度興味をもって調べれば資料はいくらでもネット上に転がっているので、要は興味をもてるか、もてないか。興味をもつキッカケをつくってあげることが教育では大事ですよね。
私は最初に化学に苦手意識をもって勉強を捨ててしまって大変もったいなかったな、と思うので、子供たちには興味をもてるように教えてあげたいと思っています。
原子モデルの変遷
科学の発展とともに、原子のモデルはさまざまに変化してきました。
最初に登場したのは トンプソンのモデル(プラムプディングモデル) です。
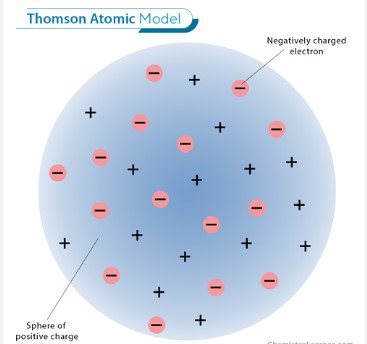
トンプソンは 陰極線実験 を通じて電子を発見しました。彼は真空管内で放電を行い、陰極から発生する光線(陰極線)が磁場や電場によって曲がることを観察し、これは負の電荷を持つ粒子によるものであると結論づけました。この粒子こそが「電子」であり、それまで考えられていた不可分な原子という概念が覆されることになったのです。
トンプソンは電子を発見したものの、原子全体の構造をどう説明するかが問題となりました。彼の提案したモデルでは、原子は「正の電荷を持つ球体の中に電子が分布している」とされました。
しかし、その後 ラザフォードの実験(アルファ粒子散乱実験) によって、原子には小さくて高密度の原子核が存在することが明らかになり、ラザフォードモデル へと発展しました。
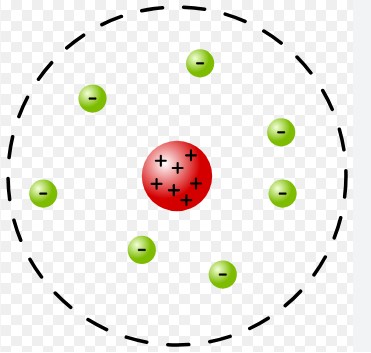
このラザフォードモデルには問題点がありました。それは「電子が原子核の周りを回転するとエネルギーを失い、やがて原子核に落ちてしまうはずだ」という点です。
この矛盾を解決するために登場したのが ボーアモデル です。ボーアは、電子は特定の軌道を回ることで安定した状態を維持できるとしました。
また、日本の物理学者 長岡半太郎 も独自の原子モデル(長岡モデル)を提案しました。彼の考えはラザフォードモデルに近いものでしたが、当時は実験的な証拠が不足していたため、あまり普及しませんでした。
ボーアモデルと現実の電子の姿
学校の教科書などでよく見かけるボーアモデルの図は、太陽系のように電子が原子核の周りを規則正しく回っているイメージですが、実際の電子の状態は異なります。
現在では、電子は「雲」のように確率的に分布している 電子雲モデル(量子力学的モデル) が主流です。
ボーアモデルは、原子構造を直感的に理解しやすいという理由で、学校の化学教育の導入部分でよく使用されています。特定の軌道を回るという概念は、電子のエネルギー準位の考え方を視覚的に示すのに適しており、化学反応や光の吸収・放出の説明に便利です。しかし、より詳しく学ぶと、電子は実際には確率的に存在し、特定の軌道にとどまるのではなく、ある範囲に分布していることがわかります。
この考え方はシュレーディンガーの波動方程式によって定式化され、電子の存在する確率の高い領域が「電子雲」として表現されます。これにより、電子の位置は完全に決まっているわけではなく、量子的な性質を持つことが明らかになりました。そのため、実際の電子の姿はボーアモデルのような単純な軌道ではなく、むしろ雲のように広がっていると考える方が適切なのです。
原子モデルの歴史を知ることで化学が楽しくなる
私は学生の頃、教科書に突然「ボーアモデル」が提示され、「これが原子の構造です」と説明されることに戸惑いを感じました。なぜこの形なのか、どのようにしてこのモデルが確立されたのかを知らなかったため、理解しづらかったのです。
偉人たちが試行錯誤しながら発展させてきたこの学問を、単なる暗記ではなく、歴史の流れとともに学べば、より理解が深まり、興味を持ちやすくなるのではないでしょうか。








コメント