昨日の学習時間:2.5h
「岡野の化学」ビデオ93、94
イオン結合まで学んで、その後ビデオ内で紹介があったサイトを復習がてら読んでみました。
そうすると原子量、質量数、原子の重さ、などの概念を曖昧に理解していることに気が付いたので、人に説明できるレベルまで理解できるよう、復習しようと思いました。ついでに計算の度にモヤモヤしていたmolについてもここで完全に理解してしまおうと思います。
原子の重さ(質量)
原子の質量とは、単一の原子の実際の質量を指す。
通常、キログラム(kg)やグラム(g)などの単位で表される。
例えば、炭素-12(¹²C)の1原子の質量は約1.9926×10⁻²³g。
しかし、これらの値は非常に小さく、物質はこれらが非常に多く集まってできているため、計算が困難。日常的な化学計算では相対質量や原子量が主に使用される。
質量数
質量数=原子核内の、陽子の数+中性子の数
¹²Cの場合、陽子数が6個、中性子数も6個で、質量数は12。
質量数は整数値であり、同じ元素でも中性子数が異なる同位体が存在するため、質量数が異なる場合がある。
例えば、
1. 水素(H)
- ¹H(プロチウム):質量数1、陽子1個、中性子0個。
- ²H(デューテリウム、重水素):質量数2、陽子1個、中性子1個。
- ³H(トリチウム、三重水素):質量数3、陽子1個、中性子2個。
2. 炭素(C)
- ¹²C:質量数12、陽子6個、中性子6個。
- ¹³C:質量数13、陽子6個、中性子7個。
- ¹⁴C:質量数14、陽子6個、中性子8個。
3. 酸素(O)
- ¹⁶O:質量数16、陽子8個、中性子8個。
- ¹⁷O:質量数17、陽子8個、中性子9個。
- ¹⁸O:質量数18、陽子8個、中性子10個。
4. 塩素(Cl)
- ³⁵Cl:質量数35、陽子17個、中性子18個。
- ³⁷Cl:質量数37、陽子17個、中性子20個。
相対質量
先ほどの¹²Cの1原子の質量、約1.9926×10⁻²³gを計算しやすくするため、¹²Cの質量を12と決め(質量数も12なので扱いやすい)、他の原子はこの¹²Cの炭素と比較して質量がどれくらいあるか、を示したのが相対質量。
例えば¹⁶Oの場合、原子の質量は約2.6560×10⁻²³gなので、
1.9926×10⁻²³:2.6560×10⁻²³=12:X
X=15.99…≒16
質量と質量の比として定義されているため、単位が相殺されてしまうので単位はなし(無次元量というらしい)。
多くの場合、質量数と相対質量の数値は近似するが、微妙に異なる。これは、原子核の結合エネルギーや電子の質量などが影響し、実際の原子質量が質量数の単純な合計とは異なるため。
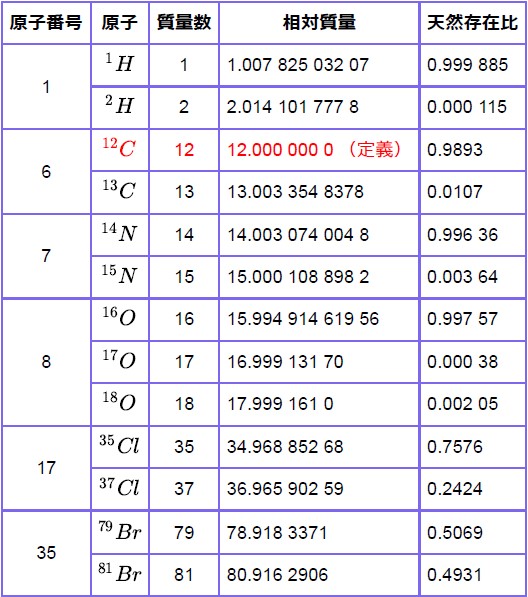
¹²Cの重さを12とすれば、¹Hの相対質量は厳密には1ではなく1.007 825 032 07、¹⁶Oの重さは厳密には16ではなく15.994 914 619 56。
化学計算においては、計算の簡便さと実用性を考慮し、相対質量を整数値で使うことが一般的。
(¹⁶Oの相対質量は16、水素(¹H)は1)
※ただし精密な計算や高度な研究においては、原子の厳密な相対質量を使用することがある。
原子量
原子量とは、自然界に存在する同位体の相対質量とその存在比を考慮した平均値のこと。
例えば、塩素(Cl)の場合、
³⁵Cl(相対質量:約34.97)と³⁷Cl(相対質量:約36.97)があり、それぞれの存在比は約75%と25%。
34.97×0.75+36.97×0.25=35.47
よって塩素の原子量は約35.5となる。
簡単な言葉で言えば、「代表的な相対質量=原子量」
相対質量同様、質量の比率として表現されるため、単位を持たない。
モル(mol)
先ほど相対質量は、「¹²Cの1原子の質量、約1.9926×10⁻²³gを計算しやすくするために、¹²Cの質量を12と決めた」と書いたが、これは炭素原子1個の重さ1.9926×10⁻²³gに6.02×10²³をかけたら12というキリのいい数字が出たのでそう決められた。
(原子1個の質量が10⁻²³ gという非常に小さい数値であるのに対し、アボガドロ数は10²³という大きな数であり、この2つを掛け合わせることで12 gというまとまった値が得られる)
この6.02×10²³は原子の粒の数といえる。これを1molとした。(アボガドロ定数)
これはどんな物質でも1mol中に含まれる原子や分子の数を示す。
つまり、1molとは「6.02×10²³個の粒子の集団」であると定義されている。
モルの概念は「個数」を直接数えるのが非常に難しい原子や分子の数を、質量という扱いやすい量に結びつけるために導入されたものである。
モル質量
ここまでのまとめとして、
原子量=ある元素(同位体を含む)の原子1個の平均の重さ であり、単位はない。
¹²Cの相対質量「12」は、1個の原子の質量(約1.9926×10⁻²³ g)× 6.02×10²³ = 約12 gで決められており、1mol の質量(12 g/mol)となるように設定されている
どんな物質でも1molには同じ数の粒子(約6.02×10²³個)が含まれている。
ここで、実際の質量(グラム)と原子や分子の個数(モル)との間の換算を簡単にするため、モル質量という1molあたりのg数が使われる。
モル質量(g/mol)を使うと、化学反応の計算や物質量の比較が直感的に行えるので非常に便利。
原子量には単位はないが、1mol の質量を表すために、この数字に単位 g を付ける。
例えば、
- 水素(H)の原子量は約1 → 水素のモル質量は約1 g/mol
- 酸素(O)の原子量は約16 → 酸素原子1個の質量をもとに計算すると、1mol の酸素原子は約16 g/mol
(※実際には、自然界では酸素は通常O₂分子として存在するため、1mol の酸素分子は約32 g/mol となるが、ここでは単一原子としての例)
こう考えると、
物質の質量(g) ÷ その物質のモル質量(g/mol)= 物質量(mol)
というグラムとモルの換算が楽にできる。
つまり、原子量に単位 g/mol を付けると、その元素の1molあたりの質量、すなわち「モル質量」となる。
おわり
今までモルの計算の度に、答えが出る理屈はわかるのに「わかったような、わからないような」いや~な気持が残っていましたが、ひとつひとつの概念の理解ができたのでこれからはないでしょう!
復習に2時間じっくりかけたので、このページを「知子の情報」にインプットし、先に進みたいと思います。








コメント