学習記録
- 学習時間:2h20m
- 「岡野の化学」ビデオ104~106
- その他ビデオ「バイオメディカル翻訳を独学でマスターできるか」
- 「4646 自己成長を妨げるような学び方はするな!」
- 「2608 分子間力から考えるライフプラン」
結晶の種類を学び終わって、極性の復習に入っています。
最近ブログで書く練習をサボっていたので、久々に勉強のアウトプットもかねて練習します。子供にもわかるように…を心がけています。
結晶とは
結晶とは、原子、分子またはイオンが、空間的に繰り返しパターンをもって規則正しく配列している固体のことです。
「結晶」と聞いて思い出すのが「氷晶」。氷の結晶の形はとても美しいですね。

氷晶は気体の水蒸気が固体になってできたもので、構造は水分子どうしが水素結合してできています。氷晶が六角形になるのは、水の分子の形が折れ線型になっており、それらが結合すると結合角が120°になるため、六角形に綺麗に並んだ結晶になるのです。
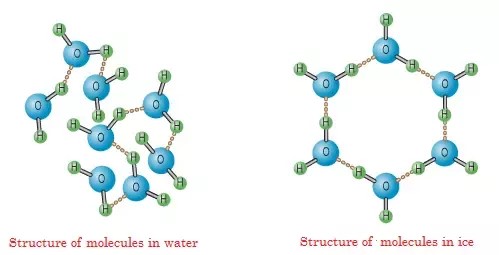
このように結晶は、原子や分子が様々な結合方法で規則正しく配列したものをいいます。逆に言うと、規則正しく並んでいないものは結晶とは言わないんですね。
結晶の種類
結合の仕方により結晶は以下のように分類できます。
- イオン結晶
- 共有結合結晶
- 金属結晶
- 分子結晶(水素結合結晶、ファンデルワールス結晶)
名前からも分かる通り、
イオン結晶は、正の電荷をもつ陽イオンと負の電荷をもつ陰イオンが互いに静電気的な引力で引き合って結合してできています。
共有結合結晶は、原子どうしが互いに電子対を共有して結合してできています。
金属結晶は、規則正しく並んだ金属原子(陽イオン)と、その陽イオンの間を自由に動き回る自由電子(マイナス)との間に働く静電気的引力によって結合してできています。
分子結晶は、分子間に働く分子間力によって結合してできています。代表的なものに水素結合結晶とファンデルワールス結晶があります。
分子間力とは―分子間力の種類―
分子間力とは、分子間に働く相互作用の総称です。
種類がいくつかあって、例えば
- イオン間相互作用
- 双極子-双極子相互作用(極性引力)
- 水素結合
- ファンデルワールス力
などがあげられます。(参照:Wiki 分子間力)
ただWikiの「イオン間相互作用」ページに飛ぶと「イオン結合」のページに飛ぶので一瞬混乱します。
イオン結合はNaClのように原子どうしの結合で覚えたけど、分子どうしにも働くのかな?
それって双極子相互作用とどう違うのかな?
結晶構造はつくるのかな?
と、疑問に思ったので調べました。
まず語句のおさらいから。
| ■双極子とは |
通常、結晶や分子は電気的に中性ですが、原子・分子レベルで見ると電荷の偏りが存在します。
分子や結晶中における電荷の偏りをもった一対の組みをまとめて双極子といいます。正負の電荷間の双極子の強さを表すベクトルを双極子モーメントと呼びます。
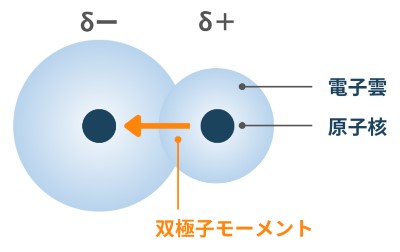
| ■ 永久双極子とは |
電場がかかっていない状態でも分子がもつ電気双極子を永久双極子と言います。永久双極子では分子を構成する各原子の電気陰性度(電子を自分の方に引き寄せる力の大きさ)の違いにより、分子内で部分的に電荷の片寄りが生じている状態です。
例えば水分子の場合。酸素原子の方が水素原子よりも電気陰性度が大きいため、電荷は酸素側が少しマイナスに、水素側が少しプラスに片寄っています。
一方、原子や電子へ外部より電場をかけることにより電荷の偏りが生じ分極することにより生じる双極子を誘起双極子と言います。
「イオン間相互作用」とは
ここで本題に戻って、
「イオン間相互作用」とは、名前の通り、イオンーイオン間に働く力の総称です。
これは2つに大別できます。
| ■イオン結合 |
イオン結合は、完全に正の電荷をもつイオンと完全に負の電荷をもつイオン間に働く静電気的な引力で結合しています。
例は先ほど取り上げたNaClで、規則正しく並び、強い静電引力によって固い結晶構造を作ります。
| ■イオン‐双極子相互作用 |
イオン‐双極子相互作用とは、一方が完全な電荷(イオン)で、もう一方が部分的な正負の電荷を持つ極性分子(双極子)の相互作用です。
例としては、NaCl水溶液(食塩水)があげられます。
Na⁺やCl⁻のイオンはそれぞれ水分子の極性部分と相互作用します。
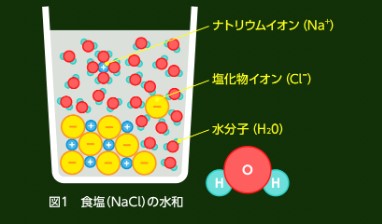
水分子は酸素側に部分的な負の電荷、水素側に部分的な正の電荷を持っているため、Na⁺は水分子の酸素原子の負電荷部分と、Cl⁻は水分子の水素原子の正電荷部分と引き合います。
その他にも、
- イオン‐π相互作用:分子内にあるπ電子系(例えば芳香族環)とイオンとの間で働く相互作用
- 塩橋(charge-assisted hydrogen bonds):タンパク質や高分子材料中で、正負の荷電基を持つ分子同士が形成する相互作用
などが「イオン‐双極子相互作用」といえます。
Wikiが言っている分子間力とはこちらのことを指すんですね。
双極子-双極子相互作用とは
ではこのイオン‐双極子相互作用は双極子-双極子相互作用とどこが違うのか?
まず双極子-双極子相互作用について。
| ■双極子-双極子相互作用 |
双極子-双極子相互作用とは永久双極子である分子どうしが、分子内の部分的な電荷の片寄りによって、互いの反対の極性に引き寄せられる静電引力のことです。
例としては以下のようなものがあります。
- 塩化水素(HCl):
HCl分子は、電気陰性度の高い塩素と、水素の間に永久的な電荷偏りを持つため、部分的に正の水素側と部分的に負の塩素側が互いに引き合います。これにより、HCl分子同士が集まる力が働き、気体状態では比較的高い沸点を示す要因の一つとなっています。
- ジクロロメタン(CH₂Cl₂):分子内に複数の極性結合を持ち、全体として永久双極子モーメントを有するため(分子内の電荷の分布が左右対称ではなく、常に一方向に偏りがあるため)、分子間で互いの正負の部分が引き合い、双極子・双極子相互作用が生じます。
各分子は部分的な正負電荷を持っていますが、どちらも完全な電荷ではないため、相互作用はイオン‐双極子相互作用に比べて弱くなる傾向があります。
イオン‐双極子相互作用は双極子-双極子相互作用の違いは、名前の通り、結合する相手が違うんですね。
イオンは正または負の完全な電荷を持つけれど、極性分子は部分的な電荷を持つ、という違いを再認識しました。
分子結晶の種類は2種類ではない!?
そして最後に、結晶構造はつくるのか?という疑問がありました。
「岡野の化学」を代表する高校生向けの参考書では、分子結晶の代表例として
- 水素結合結晶
- ファンデルワールス結晶
が取り上げられています。
では分子間力に分類される「イオン‐双極子相互作用」と「双極子-双極子相互作用」は結晶構造をもたないのでしょうか。
結論、それぞれの相互作用のみで作られる結晶構造はないようですが、他の力も同時に働いて結晶構造をつくる例はあるようです。
以下、AIに具体例を出してもらいました。
| ■イオン‐双極子相互作用が関与する結晶 |
水和物(ハイドレート)
- 例:硫酸銅(II)五水和物 (CuSO₄·5H₂O)
このような結晶では、Cu²⁺やSO₄²⁻などのイオンが、周囲の水分子とイオン‐双極子相互作用を通じて配位されています。水分子の永久双極子がイオンの電荷を部分的に中和しながら、規則正しい水和構造を作ることで結晶全体の安定性に寄与します。

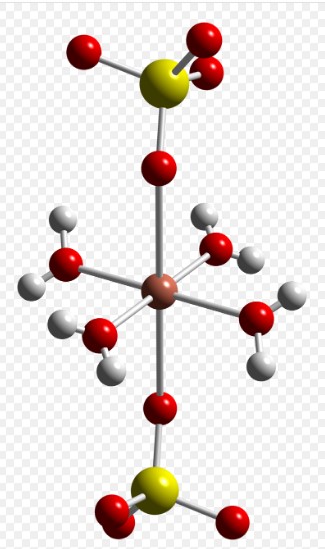
※ただしこの結晶構造形成には、他にも水分子と金属イオンとの間で配位結合(共有結合の一種)が起きており、さらに水分子は硫酸イオンの酸素原子などと水素結合も形成しています。
- 例:グラウパー塩(Glauber’s salt, Na₂SO₄·10H₂O)
このような塩の水和物でも、イオンと水分子との間のイオン‐双極子相互作用が結晶中の水分子の配位を決定付け、結晶構造の特徴となります。
| ■双極子‐双極子相互作用が関与する結晶 |
極性有機分子の結晶
- 例:アセトニトリル (CH₃CN) の結晶
アセトニトリルは分子全体に強い永久双極子を持ち、分子間で互いの正・負の極が引き合う双極子‐双極子相互作用が働いています。純粋な水素結合が形成されない場合でも、双極子‐双極子相互作用が分子の整列や結晶性に寄与することが知られています。
- 例:極性有機化合物全般
たとえば、一部の芳香族化合物やニトロ基を持つ化合物など、永久双極子を持つ分子同士は、双極子‐双極子相互作用を主要な結晶化要因として、固体状態で規則正しい構造をとることがあります。
しかし忘れてはいけないのが、これらすべての結晶構造形成には、微弱ながらファンデルワールス力は働いているということです。
なぜならファンデルワールス力は分子間に働く最も基本的な相互作用であり、すべての分子や原子間に何らかの形で働いているからです。
ここで取り上げた水素結合結晶、ファンデルワールス結晶はもちろん、分子結晶以外のイオン結合結晶、共有結合結晶、金属結晶にも分子間にはファンデルワールス力は働いています。ただし、結合力の大きさがイオン結合、共有結合、金属結合に比べて非常に小さく、全体の性質に影響を与えるレベルではないため説明は割愛されているんですね。
なので高校の参考書の文字通り、分子結晶=分子間力=ファンデルワールス力と簡易に覚えてしまうと、本質からずれてしまっていることになります。
ファンデルワールス力とは、分子間力の中の一種で、どの原子・分子間にも働いている最も弱い結合力なのです。
※しばしば意味としてのファンデルワールス力を分子間力と言ったり、水素結合のことをただ単に分子間力と言ったりする事例は見かけるので、「分子間力」というワードが、どの結合力のことを指しているのか文脈より理解しないといけませんね。
「イオン-双極子相互作用」のことかもしれないし、「双極子・双極子相互作用」のことかもしれないし!
おわりに
ここまで、「岡野の化学」で学んだことから自分の疑問点などを調べてまとめてみました。
教科書の内容だけを暗記することの恐ろしさ!全然本質をつかめていないわけです。
自分の学生時代に活を入れたいですね…
まだまだ勉強することはたくさんで歩みは遅いですが、少しづつ積み重ねていきます。






コメント