リトマス紙の思い出
小学生の頃、理科の授業で「リトマス試験紙」というものを使いましたよね。
酸性の液体につけると赤色に、アルカリ性(塩基性)の液体につけると青色になる付箋紙みたいなやつです↓

先生の説明は簡単でした。先ほどの説明を言っただけです。
「酸性の液体につけると赤色に、アルカリ性(塩基性)の液体につけると青色になるんだよ。わかったかな?」
(皆)「はーい!(挙手)」
手を挙げていないのは私だけ。周りからは「なんでわからないんだよ?」と冷笑されました。
当時の私がわからなかったのは、
「なぜ、赤と青なの? 緑とか黄色にはならないの?」
という素朴なもの。
ですが、当時の私はこの疑問を先生に聞く勇気がありませんでした。
引っ込み思案だったのもありますが、
確かクラス担任の先生がすべての教科を教えていましたから(今もそうなんですかね)、きっと納得いく答えは得られないだろう、とも生意気ながら思っていたのもあります。
あの頃の疑問はそのまま疑問のまま。
ただ一人だけ先生の話が分からなかった、劣等生のように思われた、嫌な記憶だけ残っておりましたが、この歳になって再びリトマス紙が出てきたので、あの頃の疑問に答えてみようと思います。
ただそのためには、まず「酸」と「塩基」の定義について知ることが大切です。
化学の世界では、酸と塩基の考え方にいくつかの定義があります。その代表的なものについてまとめたいと思います。
酸と塩基の定義の歴史的背景
酸と塩基の概念は、古代から人々の生活と深く関わっていました。
例えば、酸は果物や酢のように「すっぱい」ものとして知られ、アルカリ(塩基)は木灰(灰汁:あく)を水に溶かした液体から発見されました。
- 「アルカリ(alkali)」という言葉は、アラビア語の “al-qaly”(灰を焼いたもの)に由来しています。
- 酸(acid)の語源は、ラテン語の “acidus”(すっぱい)です。
中世になると、錬金術師たちはさまざまな物質の性質を研究し、酸と塩基の違いを次第に明らかにしていきました。
そして、19世紀になりアレニウスが最初の科学的な定義を提唱しました。
1. アレニウスの定義(Arrhenius)
スウェーデンの化学者スヴァンテ・アレニウスが提唱した、最もシンプルな酸と塩基の定義です。
- 酸:水に溶けて水素イオン(H⁺)を放出するもの。
- 塩基:水に溶けて水酸化物イオン(OH⁻)を放出するもの。
例えば、塩酸(HCl)は水に溶けるとH⁺とCl⁻に分かれるので酸、 水酸化ナトリウム(NaOH)は水に溶けるとOH⁻を放出するので塩基です。
HCl → H+ + Cl-
NaOH → Na+ + OH-
酸性とアルカリ性の物性の特徴
アレニウスの定義による酸と塩基には、いくつかの共通した性質があります。
酸の特徴
- すっぱい味がする(例:レモン、酢)
- 青色リトマス試験紙を赤に変える
- 金属と反応して水素を発生する(例:塩酸+亜鉛)
- pHが7より小さい
アルカリ(塩基)の特徴
- 苦い味がする(例:重曹)
- ヌルヌルした手触り(例:石けん)
- 赤色リトマス試験紙を青に変える
- pHが7より大きい
アレニウスによる酸と塩基の定義では、上記のような「物性としての酸性・アルカリ性を示す物質」を酸・塩基と呼びました。なので「アレニウス塩基のことをアルカリという」といった文献もみられます。
ただし、この定義は「水溶液中」に限られるという制約がありますし、自身からH+やOH-を放出しないのに酸性・アルカリ性を示す物質の説明には不十分な定義でした。
例えばアンモニア(NH₃)は、水に溶けるとNH₄+とOH-になり、塩基性を示しますが、NH3から直接OH-が出ているわけではありません。H₂OからH+が1つ離れてNH₃に結合し、残りがOH-になっているのです。
NH₃ + H₂O ⇔ NH₄+ + OH-
2. ブレンステッド・ローリーの定義(Brønsted-Lowry)
その後数十年経って、デンマークの化学者ブレンステッドと、イギリスのローリーが同時期に提唱した定義があります。
- 酸:水素イオン(H⁺)を他の物質に与えるもの。
- 塩基:水素イオン(H⁺)を受け取るもの。
アレニウスの定義を広げ、水以外の溶媒でも考えられるようになりました。
例えば、先ほどのアンモニア(NH₃)は、水の中でH⁺を受け取ってNH₄⁺になるため、塩基として働きます。一方H₂OはH+をNH₃に与えているため、酸として働きます。
NH₃ + H₂O ⇔ NH₄+ + OH-
このようにブレンステッドとローリー(代表してブレンステッド)の定義では、酸と塩基は相手物質による相対的な概念となっています。
この定義に当てはまる酸をブレンステッド酸といい、同様に塩基もブレンステッド塩基といいます。
共役酸と共役塩基
また、ブレンステッド塩基がH+を受け取った後の物質のことを共役酸といい、同様にブレンステッド酸がH+を放出した後の物質を共役塩基といいます。
先ほどのアンモニアと水の反応式をみると、
NH₃ + H₂O ⇔ NH₄+ + OH-
ブレンステッド塩基 + ブレンステッド酸 ⇔ 共役酸 + 共役塩基
という関係になっています。
共役酸であるNH₄+はH+を放出するともとのNH₃に戻り、OH-もH+を受け取るともとのH₂Oにもどります。
ここでの「共役」とは、「あるものと対を成して関係している」という意味です。
ブレンステッド酸とブレンステッド塩基は、H+をやり取りすることで互いに変化する関係(=共役な関係)であるといえます。
水は両性
先ほどのアンモニアの例ではH₂Oは酸として働きましたが、塩基としても働きます。
例えば塩化水素の反応式では、
HCl + H₂O ⇔ Cl- +H₃O+
ブレンステッド酸 + ブレンステッド塩基 ⇔ 共役塩基 + 共役酸
の関係になっています。
このようにブレンステッド・ローリーの定義では、アレニウスの定義でカバーできなかった部分も定義に当てはめられるようになり便利です。
ですが、この定義だと水素イオンH+がなければ成り立たないので、水素イオンがない化学反応には適用できません。
3. ルイスの定義(Lewis)
そこで登場したのが、アメリカの化学者ギルバート・ルイスが提唱した更に広い定義です。
- 酸:電子対を受け取るもの(電子対受容体)
- 塩基:電子対を与えるもの(電子対供与体)
この定義は、H⁺をやりとりするかどうかに関係なく、電子のやりとりだけで酸と塩基を決めるので、金属触媒反応や有機化学の分野でも使われます。(これらの定義に当てはまる酸・塩基をそれぞれルイス酸・ルイス塩基という)
例えばホウ素トリフルオリドとフッ化物イオンとの反応では、
BF₃ + :F- ⇔ BF₄-
ルイス酸 + ルイス塩基
となり、電子対の授与が関係してくるのでルイス酸とルイス塩基は必ずペアで考えます。(「:F-」の「:」は非共有電子対を表す)
つまり、
- ルイス酸:低エネルギーの空軌道をもつ化学種(電子対を受け入られる状態)
- ルイス塩基:非共有電子対を持つ化学種(電子対を与えられる状態)
といえます。
先ほどのアンモニアの反応式をルイス定義で考えてみます。
アンモニアの反応式はこうでした。
NH₃ + H₂O ⇔ NH₄+ + OH-
これをより正確な状態に直します。
そうすることで電子対の授与がよりわかりやすくなります。
H+の存在について
まず水は通常の状態ではわずかにヒドロニウムイオン(H₃O+)と水酸化物イオン(OH-)に解離しています(この現象を自己解離という)
2H₂O ⇔ H₃O+ + OH-
溶液中では、自由な 水素イオンH+(単独のプロトン)はほぼ存在せず、水分子と結合して H₃O⁺ の形で存在します。
実際には H₃O⁺ だけでなく、 H₅O₂⁺ や H₉O₄⁺ などの水和した形でも存在することが知られています。
先ほどのアンモニアと水の反応をヒドロニウムイオンを使って書くと、
:NH₃ + H₃O+ ⇔ NH₄+ + H₂O
ルイス塩基 + ルイス酸
という式になります。
この後ウサノビッチの定義というものも登場しますが、この定義では電子までも塩基の対象となり、解釈を拡大するとすべての化学反応を包括することになってしまうため、この定義が用いられることはほとんどありません。
私の疑問の答え
酸と塩基の定義が理解できたところで、当時の疑問「なぜリトマス試験紙の色は赤と青なの?」に戻ります。まずはリトマス試験紙が赤色・青色である理由についてまとめます。
共役二重結合と可視光線の吸収波長
リトマス試験紙には「リトマス色素」という色素が使われています。
このリトマス色素は「オルセイン」や「アゾリトミン」 という 天然の化学物質 の混ざったもので、「分子の形が変わる ことで色が変化する」という性質をもっています。
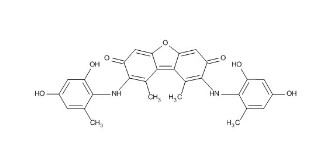
この「分子の形が変わると色が変化する」を深掘りすると、
オルセインやアゾリトミンは、共役系 という特殊な分子構造を持っており、この 共役系の長さ(数)が変わると、光の吸収する波長が変わる ので、色が変わります。
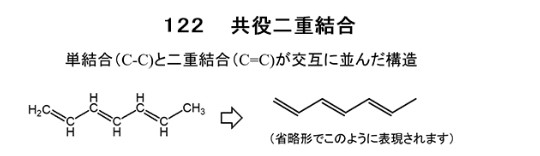
物質が光を吸収すると、電子が高いエネルギーの軌道にジャンプ(遷移)します。この時、遷移前後のエネルギー差に等しい波長の光が吸収される事になります。
一般的な化合物の結合は紫外線領域(400nm以下)の光を吸収しますが、共役系をもつ化合物の場合、軌道の数が一般的な化合物より多く、電子遷移に必要なエネルギー量が少なくなります。
このため、波長が長くエネルギーの低い可視光領域(400~800nm)の光を吸収するようになります。
具体的には、共役二重結合が5つ以上になると青い光を吸収するようになり、さらに長くなると緑色の光を吸収するようになります。吸収された残りの波長の光が反射して、人間の目に色として映るのです。
私たちが見る色は、物質に吸収されなかった残りの色(補色または余色という)なのです。
酸性 → 赤色
酸性溶液の中には水素イオンH+がたくさん含まれており、H+がくっつく反応(プロトン化)が起こります。
プロトン化すると電子の動きが制限され、共役系が短くなります。吸収する光の波長が短くなり、青や緑の光を吸収しやすくなり、結果赤色が目に見えるのです。
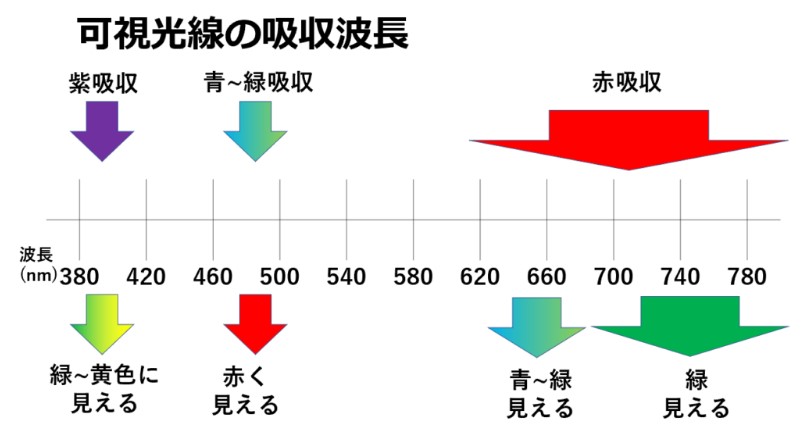
アルカリ性 → 青色
アルカリ性の溶液には、水素イオンH⁺が少なく、かわりに 水酸化物イオン(OH⁻) が多くあります。
そのためOH⁻がH⁺を取り去る脱プロトン化 という反応が起こります。
脱プロトン化が起こると共役系は広がり、電子が自由に動きやすくなります。
共役系は長く、吸収する光の波長も長くなると、赤や黄の光を吸収しやすくなります。結果、私たちの目には青色に見えるのです。
なぜ「pH試験紙」 ではないの?
リトマス紙以外にも「pH試験紙」 というものもあります。これは 酸性やアルカリ性の強さ によって、黄色や緑、オレンジなどいろんな色に変わる特別な紙です。
色の変化によって酸性・アルカリ性を判断するなら、こっちでもよさそうです。
小学校の実験では、なぜpH試験紙ではなく、リトマス紙をつかったの?
という疑問が出てくると思いますが、これには理由があります。
リトマス紙の色の変化の方が、人の目が識別しやすくわかりやすいから
例えば、「黄色 → オレンジ」や「緑 → 黄緑」では、すぐに気づきにくいです。
赤と青は、色の違いがとても はっきり していて、たとえ色覚異常があったとしてもすぐにわかります。私たちの目は 赤と青の違いをとてもよく見分けられる しくみになっているのです。
もし黄色や緑を使うと、いろんな色にまざってしまい、正しく判定できないことがあるかもしれません。
リトマス試験紙は 赤→青、青→赤という変化のみでシンプルでわかりやすい ので、学校や実験で今でもよく使われているんですね。
このことを当時の私にかみ砕いて教えてくれる人に出会いたかったな。もし出会っていたら、私だって理系の道に進んでいたかもしれません。
それくらい、子供の頃の疑問・経験って大事ですよね。
ママは我が子どもたちの疑問にはしっかり答えてあげるからね!
おわりに
講座のビデオの中で「酸と塩基の定義のところは大事だから人に説明できるレベルにならないと」と言っていたので、説明できるかブログを通してアウトプットしてみました。
途中、昔の苦い記憶も思い出されましたが、あの頃の疑問にも答えることができました。
また、ルイス定義の中ではBF₃とBF₄-の混成軌道の復習もでき、今回の学習は一石三鳥ぐらい。
ルイス酸→低エネルギーの空軌道→LUMOとHOMO→フロンティア軌道論についても少しかじりました。
コンデンサの記事をパラパラ眺めていた時に出てきたバンドギャップという言葉の意味も、何となく想像できました。
アウトプットも大事にしながら基礎学習を続けていきたいです。








コメント