昨日の学習時間:3.5h
「岡野の化学」ビデオ81~83
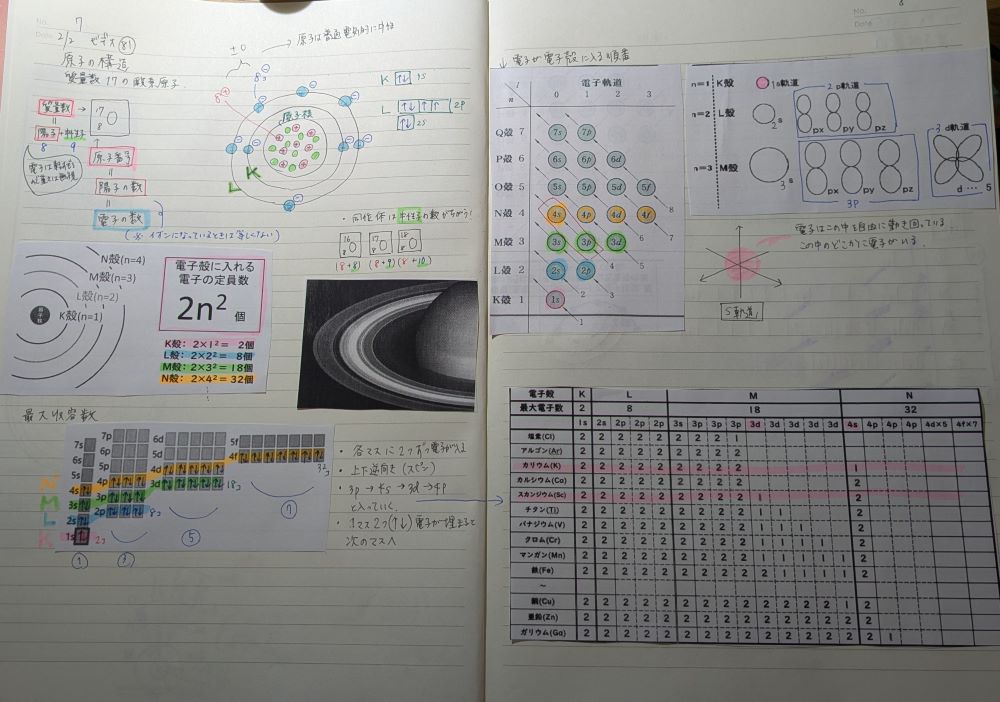
原子の構造についておさらいです。自分がちゃんと理解できているか、何も見ないで説明できるか、確認のためつらつらと書きます↓
原子とは、物質を構成している最小粒子のこと。
基本的な構造は、中心に原子核があり、その中に正電荷をもつ陽子と電気的に中性な中性子がある。そして負電荷をもつ電子がその原子核の周辺の軌道上に一定の確率で分布している。
原子番号はその元素の陽子の数。質量数は陽子と中性子を合わせた数になっている。
原子は普通電気的に中性なので、正電荷を持つ陽子の数と負電荷をもつ電子の数は一致する。(イオンの場合はこれが一致していない)
電子の軌道は一番内側から順にK殻、L殻、M殻、N殻…と名前がついていて、それぞれの電子殻に入れる電子の最大収容数は2n2で決まっている。
電子殻の中にはさらに軌道があって、s軌道、p軌道、d軌道、f軌道…と名前が付いている。これらにも最大収容数があって、例えばs軌道は上下逆向きの電子2つまで、p軌道は上下逆向きの電子2つが最大6つまで入る。
これらの軌道に電子が入る順番も決まっている。
電子はまず最初にK殻のs軌道に上下逆向きで電子が2つ入る。K殻にはs軌道しかなく、これで最大収容数を満たすので、次に電子が入るところはL殻のs軌道(2s軌道)の2つ。L殻はp軌道まであるので、s軌道が埋まり、次のp軌道の最大収容数6つまで電子が入ると、その次はM殻の3s軌道に入る。
M殻はs、p、d軌道まであるので、p軌道まで電子が埋まったら次はd軌道に入りそうだが、実際はM殻のp軌道(3p)の次はN殻のs軌道(4s)に電子は入る。
これは電子はエネルギーの低い方へ入って安定化しようとする性質があり、3d軌道より4s軌道の方がエネルギー準位は低いために起こる。
spdf軌道のマスの画像を何個かコピペして、ノートで軌道の入り方を頭に入れました。
パウリの排他原理、フントの法則。
そして気になったのは原子番号24のCr(クロム)と原子番号29のCu(銅)。1マスにスピンが2つ入っていないのに次の軌道に電子が入っている件。調べるとこっちの方が安定化するから…とのこと。全ての現象に理論づけするとこういう例外は出てきますよね。後々遷移元素のところで出てくるかな。遮蔽による効果が関係するらしい。今はこういうものだと思って、ノートには書き込めるようスペースを空けておいて先に進みます。





コメント